ALCOHOLES Y FENOLES
INTRODUCCIÓN:
En este blog hablare sobre los alcoholes y fenoles, también de sus obtenciones, propiedades tanto físicas y químicas, sus aplicaciones y algunas generalidades, ya que hoy en día son de suma importancia y tienen muchas utilidades en diferentes campos de la ciencia.
OBJETIVOS:
● Obtener nuevos conocimientos acerca de la temática.
● Enseñar y aprender sobre la química y las aplicaciones de las ecuaciones.
●Distinguir y caracterizar las propiedades físicas y químicas de los alcoholes y fenoles.
● Aplicar ejercicios para lograr diferenciar entre los alcoholes y los fenoles; y aprender a enumerar las cadenas carbonadas y saber nombrarlos de manera correcta.
MARCO TEÓRICO:
ALCOHOLES:
“Los alcoholes son compuestos orgánicos que contienen grupos hidroxilo, es decir, un — OH.”
A partir de los alcoholes, también se pueden obtener muchos compuestos con diferentes grupos funcionales. Su estructura, es similar a la del agua, solo que se reemplaza uno de los átomos de hidrógeno del agua, por un grupo alquilo. Como todo en la vida, los alcoholes también tienen categorías, ya que encontramos los grupos hidroxilo unidos a diferentes estructuras; una forma de organizarlos, es basándose en el tipo de átomo de carbono al que esta unido, por ejemplo, si es un carbono primario, obviamente tendremos un alcohol primario. Si esta unido a un carbono secundario, sera un alcohol secundario, por lo tanto un alcohol terciario esta unido a un carbono terciario.
Propiedades físicas - Alcoholes
- Solubilidad en agua: gracias al grupo -OH característico de los alcoholes, se pueden presentar puentes de hidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendo importancia y a partir del hexanol la sustancia se torna aceitosa.
- Punto de ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrógeno, son mas difíciles de romper.
- Punto de fusión: Presenta el mismo comportamiento que el punto de ebullición, aumenta a medida que aumenta el numero de carbonos.
- Densidad: Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moléculas.
Propiedades químicas -
Alcoholes
Las propiedades químicas de un alcohol, ROH, están
determinadas por su grupo funcional, el grupo hidroxilo, -OH.
Las reacciones de un alcohol pueden
involucrar la ruptura de uno de dos enlaces: el enlace C-OH, con eliminación
del grupo -OH, o el enlace O-H, con eliminación de -H.
Los alcoholes pueden reaccionar de
manera que retengan el oxígeno o que lo pierdan. Son bastante reactivos y sus
reacciones básicas son las siguientes:
- Deshidrogenacion de los alcoholes: Los alcoholes
primarios y secundarios cuando se calientan en contacto con ciertos
catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si
esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante
se combina con el oxígeno para dar agua.
- Reacción con acidos: Los alcoholes
reaccionan con los ácidos orgánicos e inorgánicos fuertes para formar los
ésteres. Los ésteres obtenidos de ácidos inorgánicos es frecuente encontrarlos
como ésteres inorgánicos.
CH3OH
+ SO4H2 --------------->
CH3O-SO2-OCH3
- Reacción con los metales
alcalinos y alcalinotérreos: Los
alcoholes e comportan como ácidos débiles en presencia de bases
fuertes, como es el caso de los metales alcalinos y
algunos alcalinotérreos, produciendo hidrógeno y un
compuesto denominado alcóxido metálico.
Na + CH3CH2OH
---------------> CH3CH2ONa + H2
- Deshidratacion: es una propiedad de
los alcoholes mediante la cual podemos obtener eteres o alquenos:
2
R-CH2OH ---------------->
R - CH2 - O - CH2 - R'
R-R-OH ------------> R=R + H2O
Nomenclatura y clasificación - Alcoholes
Los alcoholes al igual que otros compuestos
orgánicos, como las cetonas y los éteres, tienen diversas maneras de
nombrarlos:
Común (no sistemática): se antepone la palabra alcohol a la base del alcano
correspondiente y se sustituye el sufijo -ano por -ílico.
Así por ejemplo tendríamos
- Metano ------- alcohol
metílico.
- Etano ---------
alcohol etílico.
- Propano ------ alcohol
propílico.
- Metano ------ metanol
en donde met- indica un
átomo de carbono, -ano- indica que es un hidrocarburo alcano
y -l que se trata de un alcohol.
También se presentan alcoholes en los cuales se hace necesario identificar la
posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo,
por ejemplo:
2-butanol
en donde el dos significa que en en el carbono
dos (posición en la cadena), se encuentra ubicado el grupo hidróxido, la
palabra but nos dice que es una cadena de cuatro carbonos y la -l nos
indica que es un alcohol.
Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi.
Se utilizan los sufijos -diol, -triol, etc., según la
cantidad de grupos OH que se encuentre.
- Deshidrogenacion de los alcoholes: Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
- Reacción con acidos: Los alcoholes reaccionan con los ácidos orgánicos e inorgánicos fuertes para formar los ésteres. Los ésteres obtenidos de ácidos inorgánicos es frecuente encontrarlos como ésteres inorgánicos.
- Reacción con los metales alcalinos y alcalinotérreos: Los alcoholes e comportan como ácidos débiles en presencia de bases fuertes, como es el caso de los metales alcalinos y algunos alcalinotérreos, produciendo hidrógeno y un compuesto denominado alcóxido metálico.
- Deshidratacion: es una propiedad de los alcoholes mediante la cual podemos obtener eteres o alquenos:
- Metano ------- alcohol metílico.
- Etano --------- alcohol etílico.
- Propano ------ alcohol propílico.
- Metano ------ metanol
en donde met- indica un átomo de carbono, -ano- indica que es un hidrocarburo alcano y -l que se trata de un alcohol.
También se presentan alcoholes en los cuales se hace necesario identificar la posición del átomo del carbono al que se encuentra enlazado el grupo hidroxilo, por ejemplo:
2-butanol
en donde el dos significa que en en el carbono dos (posición en la cadena), se encuentra ubicado el grupo hidróxido, la palabra but nos dice que es una cadena de cuatro carbonos y la -l nos indica que es un alcohol.
Cuando el grupo alcohol es sustituyente, se emplea el prefijo hidroxi.
Se utilizan los sufijos -diol, -triol, etc., según la cantidad de grupos OH que se encuentre.
CLASIFICACIÓN DE ALCOHOLES
Entonces, si nos
encontramos con un grupo hidroxilo unido a un anillo aromático, se le llamara
fenol.
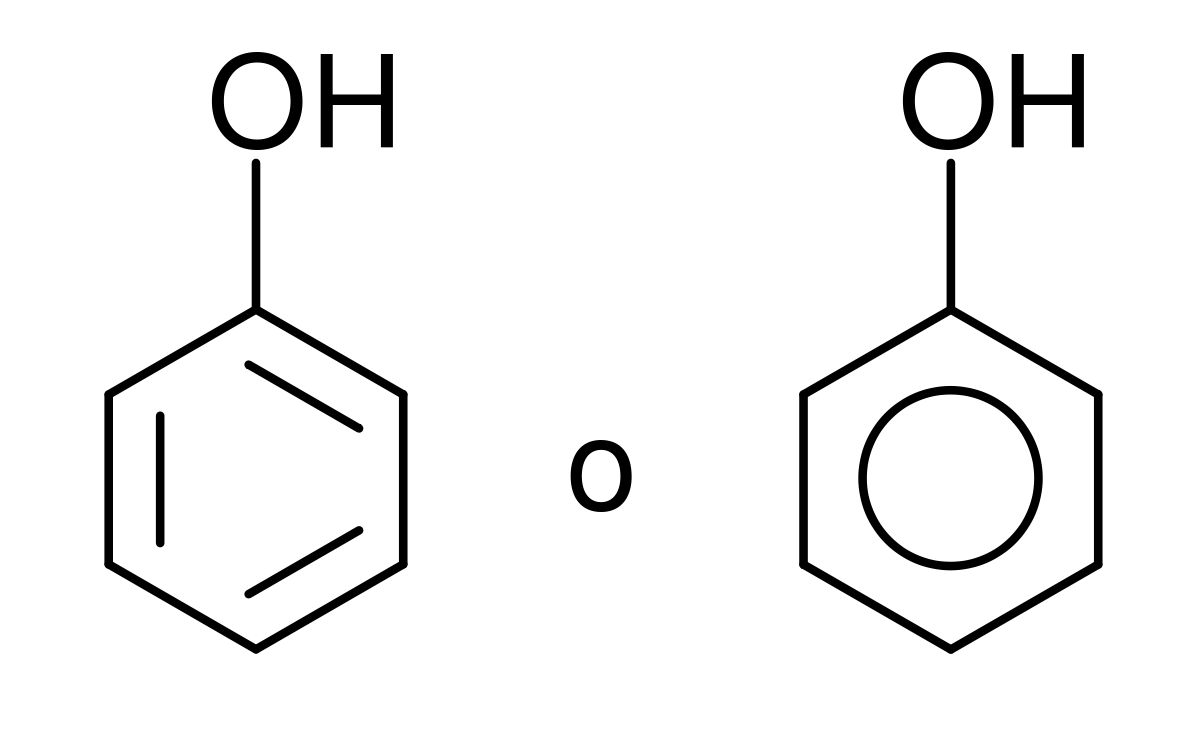
“Los fenoles tienen propiedades
similares a la de los alcoholes, pero algunas de ellas, derivan mas que nada
del anillo aromático al que se encuentran enlazados.”
NOMENCLATURA: Reglas IUPAC
1. Se nombra la
cadena más larga de carbonos que contiene al átomo de carbono enlazado con el
grupo — OH. En la terminación “ano”, “eno” o “ino”, se sustituye la “o” por
“ol”.
2. La cadena de
carbonos (más larga), se nombrara comenzando por el extremo más cercano al
grupo — OH. “El grupo hidroxilo tiene preferencia sobre los dobles o
triples enlaces.”
3. Se nombran los
demás sustituyentes precedidos de los números de carbonos sobre los que están
localizados, así como para nombrar a los alcanos o alquenos.
Ejemplo:

La cadena de
carbonos más larga tiene cuatro, por lo tanto, su nombre base es butanol.
El grupo — OH se
encuentra en el carbono 2, por lo que sería: butan-2-ol.Entonces,
siguiendo las reglas IUPAC, el nombre de este compuesto es: 1-bromo-3,3-
dimetilbutan-2-ol.
En el caso de los
alcoholes ciclicos, se nombran utilizando el prejifo “ciclo”. Al
carbono que este unido al grupo — OH se le da el número uno.
Los alcoholes que
tienen dos grupos — OH, se llaman dioles. Y se nombran exactamente igual que
los alcoholes, solo que se usará el sufijo “diol” y los numero
del carbono en el que estarán, por ejemplo: “Hexa-1,5-diol”.
Para nombrar a
los fenoles si se deben seguir cierto tipo de criterios, dado que incluye un
anillo aromatico. Con frecuencia
se siguen los siguientes criterios:
1. ORTO (1,2- disustituido)
2. META (1,3- disustituido)
3. PARA (1,4- disustituido)


Para nombrar a los fenoles si se deben seguir cierto tipo de criterios, dado que incluye un anillo aromatico. Con frecuencia se siguen los siguientes criterios
Métodos de obtención - Alcoholes
Reducción de aldehídos: Los aldehídos con hidrógeno y en presencia de un catalizador como el níquel forman alcoholes primarios.
Combinando halogenuros de alquilo con hidróxidos fuertes:
Por reducción de ácidos:
A través del reactivo de Grignard: El reactivo es el ioduro de alquil magnesio.
Este intermediario reacciona posteriormente con agua para dar yoduro básico de magnesio y el alcohol buscadom, en este caso propanol.
Ejemplos de Alcoholes
Alcohol Metílico o Metanol [CH3OH]
Alcohol Etílico o Etanol [C2H5OH]
Alcohol Propílico o Propanol [C3H7OH]
Alcohol isopropílico [CH3-CHOH-CH3]
Alcohol Butílico o Butanol [C4H9OH]
Alcohol Pentílico o Pentanol [C5H11OH]
EtilenGlicol [CH2OHCH2OH]
PropilenGlicol [CH3CH2OHCH2OH]
Glicerina o Propanotriol [CH2OH-CHOH-CH2OH]
Alcohol Cetilico [C16H33OH]
Alcohol Miricilico [C30H61OH]
FENOLES:
Propiedades quimicas - Fenoles Los fenoles pueden reaccionar de dos maneras diferentes, en una los cambios químicos se producen en el grupo hidroxilo y en la otra en el propio anillo bencénico.
- Los fenoles tienen a diferencia de los alcoholes que pueden reaccionar con el hidróxido de sodio formando una sal, el fenóxido de sodio. En este caso el ion sodio sustituye al hidrógeno del grupo hidroxilo, EJEMPLO:
Cuando el fenol reacciona con el bromo (halogenación) se forma un tribromofenol, en el cual se acoplan tres átomos de bromo en los vértices del anillo bencénico quedando el grupo hidroxilo intacto.
Métodos de obtención - Fenoles
- Hidrohalogenación de Fenoles:
- Nitración Fenoles:
- Apartir de Clorobenceno y NaOH
Reacciones de los Fenoles:
Formación de Sales: al ser ácidos reaccionan con las bases para formar sales.
Formación de Éteres.
Formación de Ésteres.
Nitración.
Sulfonación.
Halogenación.
Usos de los Fenoles:
Es empleado en la industria para la fabricación de:
Colorantes
Aspirinas
Explosivos
...
Clasificación y Ejemplos de los Grupos Funcionales:
- Alquilo: formado por Alcanos. Da lugar a Radicales Alquilo (-CH3 metilo, -CH2CH3 etilo...)
- Alquenilo: formado por Alquenos. Da lugar a Radicales Alquenilo (-CH=CH-CH3 1-propenilo...)
- Alquinilo: formado por Alquinos. Da lugar a Radicales Alquinilo (-C≡CH etinilo...)
- Hidroxilo: R-OH. Da lugar a los Alcoholes (CH3OH alcohol metílico, CH3CH2OH alcohol etílico...)
- Alcoxi: R-O-R'. Da lugar a los Éteres (CH3OCH2CH3 metoxietano, CH3OCH=CH2 metoxieteno...)
- Carbonilo: R-(C=O)-R'. Da lugar a dos tipos de compuestos:
- Aldehídos: cadena acabada en R-HC=O. Ejemplos: HCHO metanal, CH3-CHO etanal...
- Cetonas: R-(C=O)-R'. Ejemplos: CH3-(C=O)-CH3 propanona, CH3CH2-(C=O)-CH2CH3...
- Carboxilo: R-(C=O)-OH. Da lugar a dos tipos de compuestos:
- Ácidos Carboxílicos: CH3COOH ácido acético...
- Amino: R-NR'R'' o RR'C=N-R''. Da lugar a dos tipos de compuestos:
- Aminas: CH3-NH-CH3 dimetilamina...
- Aminas: CH3C=N-CH3...
- Amino-Carbonilo: R-(C=O)-NR'H o R-(C=O)-NR'R". Da lugar a los siguientes compuestos:
- Amidas: CH3-CO-NH2...
- Imidas: HCONHCOCH3...
- Nitro: R-NO2. Da lugar a los Nitrocompuestos: CH3-CH2-CH2-NO2...
- Nitrilo: R-C≡N o R-N≡C. Da lugar a:
- Nitrilos o Cianuros: H-C≡N...
- Isocianuros: CH3-N≡C...
PROPIEDADES DE LOS FENOLES:
Los fenoles: son compuestos que presentan uno o más grupos hidroxi (OH) unidos directamente a un anillo aromático . El fenol es el miembro más sencillo de esta serie homóloga y es denominado también hidroxi-benceno.
Propiedades Físicas:
Los fenoles presentan algunas propiedades semejantes a los alcoholes, debido a la presencia del grupo –OH. Sin embargo conforman otra familia química y la mayoría de sus propiedades y los métodos para su obtención son diferentes
 Solubilidad: El fenol es poco soluble en agua ya que aunque presentan el puente de hidrógeno, la proporción de carbonos con respecto a la cantidad de –OH es muy baja.
Solubilidad: El fenol es poco soluble en agua ya que aunque presentan el puente de hidrógeno, la proporción de carbonos con respecto a la cantidad de –OH es muy baja.
 Para que los compuestos que contienen grupos –OH sean solubles en agua la razón entre carbonos y grupos –OH no debe ser mayor de 3:1. El fenol es el miembro más pequeño de este grupo y contiene 6 átomos de carbono y sólo uno de -OH.
Para que los compuestos que contienen grupos –OH sean solubles en agua la razón entre carbonos y grupos –OH no debe ser mayor de 3:1. El fenol es el miembro más pequeño de este grupo y contiene 6 átomos de carbono y sólo uno de -OH.
 Los demás monofenoles poseen mayor número de carbonos y sólo un grupo OH, por ello son insolubles en agua. Los difenoles y polifenoles con más de un grupo –OH presentan mayor solubilidad en el agua.
Los demás monofenoles poseen mayor número de carbonos y sólo un grupo OH, por ello son insolubles en agua. Los difenoles y polifenoles con más de un grupo –OH presentan mayor solubilidad en el agua.
Propiedades Físicas:
Los fenoles presentan algunas propiedades semejantes a los alcoholes, debido a la presencia del grupo –OH. Sin embargo conforman otra familia química y la mayoría de sus propiedades y los métodos para su obtención son diferentes
Los fenoles más sencillos son líquidos o sólidos blandos e incoloros y se oxidan con facilidad por lo que se encuentran coloreados. En presencia de impurezas o bajo influencia de la luz, el aire y ciertos compuestos como el cobre y el hierro, el fenol puede teñirse de amarillo, marrón o rojo.
Propiedades Químicas:
Las propiedades de los fenoles están influenciadas por sus estructuras, en la reacción que se presenta a la derecha de este texto el fenol cede un protón al agua para formar el ión hidronio, de acuerdo a esto, el fenol se comporta como un ácido.
El fenol presenta cinco estructuras contribuyentes, es decir que pueden ceder protones. Dos de estas estructuras corresponden a la resonancia del anillo bencénico. La resonancia viene dada por la ubicación de los dobles enlaces dentro de la molécula.
Síntesis del Fenol: Existen varios métodos para obtener compuestos fenólicos, entre ellos se cuentan la hidrólisis del clorobenceno, obtención a partir del benceno-sulfonato de sodio y la oxidación del isopropil-benceno. Hidrólisis del clorobenceno: para obtener el fenol, el clorobenceno se trata con una solución de hidróxido de sodio a ebullición y alta presión para obtener fenóxido de sodio. El fenóxido de sodio es una sal que reacciona con el ácido clorhídrico para formar fenol.
Ejemplos:

bencenol hidroxibenceno (fenol)

1,2-bencenodiol (pirocatecol)

1,2-bencenodiol (resorcinol)

1,2-bencenodiol (hidroquinona)

4-etil-1,3-bencenodiol
Ejemplos:
bencenol hidroxibenceno (fenol)
1,2-bencenodiol (pirocatecol)
1,2-bencenodiol (resorcinol)
1,2-bencenodiol (hidroquinona)
4-etil-1,3-bencenodiol
WEBGRAFIA:
ALCOHOLES 2
FENOLES 1
FENOLES 2












