INTRODUCCIÓN:
En este blog se hablara sobre las reacciones y ecuaciones químicas, sus conceptos, tipos y métodos con los cuales podemos realizar un proceso correcto a la hora de un balanceo o solución teniendo en cuenta la clasificación de sus componentes químicos.
OBJETIVOS:
- Reconocer las reacciones y ecuaciones químicas a la hora de realizar un balanceo.
- Identificar los tipos de reacciones y métodos para resolverlas dependiendo de sus componentes.
REACCIONES QUÍMICAS
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias llamadas reactantes o reactivos, que se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos.
Los reactantes pueden ser elementos o compuestos.
Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida. A la representación simbólica de cada una de las reacciones se le denomina ecuación química. Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se obtiene la reacción química.
Delante de cada fórmula se pone el número de unidades del elemento o del compuesto que intervienen en la reacción (excepto si ese número es 1) de manera que una vez completada, para cada elemento debe haber el mismo número de átomos en ambos términos. Por ejemplo, para indicar que cuando el carbono (C) se quema en presencia del oxígeno del aire (O2) se forma dióxido de carbono (CO2), se escribiría:
C + O2 → CO2
Si queremos escribir la reacción entre el hidrógeno (H2) y el oxígeno (O2) para formar agua (H2O), pondremos:
2 H2 + O2 → 2 H2O
Y si queremos describir que la piedra caliza (carbonato de calcio: CaCO3) se descompone por el calor dando cal viva (óxido de calcio: CaO) y dióxido de carbono (CO2), tendríamos:
CaCO3 → CaO + CO2
TIPOS DE REACCIONES QUÍMICAS:
En química de pueden clasificar la reacciones en 7 tipos que son:
1.DE COMBINACIÓN O SÍNTESIS: Se caracterizan porque los reactivos se unen para formar productos de reacción más complejos desde el punto de vista químico. La formación de un compuesto a partir de sus elementos correspondientes es el tipo de reacción de síntesis más sencilla.
A + B —– > AB
Ejemplo:
- Fe + S —– > FeS
- 2H2 + O2 —– > 2H2O
- H2O + CO2—– > H2CO3
- 2 H2 + O2 → 2 H2O
- N2 + 3 H2 → 2 NH3
2. DE DESCOMPOSICIÓN: Al contrario que en las reacciones de síntesis, los productos son en este caso sustancias más sencillas que los reactivos.
AB —– > A + B
Ejemplo:
- 2H2O 2 H2 + O2
- 2H2O2 2H2O + O2
- 2 HgO → 2 Hg + O2
3. DE SUSTITUCIÓN O DESPLAZAMIENTO: Tienen lugar cuando siendo uno de los reactivos una sustancia simple o elemento, actúa sobre un compuesto desplazando a uno de sus elementos y ocupando el lugar de éste en la correspondiente molécula. Así las reacciones de ataque de los metales por los ácidos llevan consigo la sustitución del hidrógeno del ácido por el metal correspondiente.
AB + C —– > A + CB
Ejemplo:
- Zn + 2 HCl → H2 + ZnCl2
- 2Na + 2H2O —– > 2NaOH + H2 (el sodio desplaza al hidrógeno del agua H-OH)
- Au + HCl —– > no reacciona (el oro no consigue desplazar al hidrógeno)
4. DE INTERCAMBIO O DE DOBLE DESPLAZAMIENTO: Se producen entre dos compuestos y equivalen a un intercambio o sustitución mutua de elementos que da lugar a dos nuevas sustancias químicamente análogas a las primeras.
AB + CD —– > AD + CB
Ejemplo:
- FeCl3 + 3 NH4OH → Fe(OH)3 + 3 NH4Cl
- NaCl + LiNO3 —– > NaN
5. ÁCIDO-BASE: Cuando reacciona un ácido con una base para formar agua más un compuesto iónico llamado sal.
“ácido+base=sal+agua”.
Ejemplo:
- HCl + NaOH → NaCl + H2O
- Ca(OH)2 (ac) + HCl(ac) → CaCl2 (ac) + 2 H2O (l)
- Como uno de los productos es agua (H2O), la reacción ocurre.
7. OXIDACIÓN-REDUCCIÓN (REDOX): Se estudiarán más adelante. Son reacciones en las que se intercambian electrones, por lo que cambian los estados de oxidación de algunos elementos.
Ejemplo:
Reacción de un metal con un ácido
- 2 KI + 2 FeCl3 → 2 FeCl2 + I2 + 2 KCl
- Zn (s) + 2 HCl (ac) → ZnCl2 (ac) + H2 (g)
ECUACIÓN QUÍMICA
Una ecuación química es una descripción simbólica de una reacción química. Muestra como las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
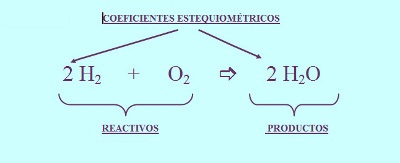
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
El símbolo + se lee como «reacciona con», mientras que el símbolo → se lee como «produce». Para ajustar la ecuación, ponemos los coeficientes estequiométricos:
La ecuación está ajustada y puede ser interpretada como 2 mol de moléculas de hidrógeno reaccionan con 1 mol de moléculas de oxígeno, produciendo 2 mol de moléculas de agua.
Las fórmulas químicas a la izquierda de la flecha de reacción (→) representan las sustancias reaccionantes o reactantes; a la derecha de la flecha de reacción están las fórmulas químicas de las sustancias producidas, denominadas productos.
Los números adelante de las fórmulas son llamados coeficientes estequiométricos. Estos son para que la ecuación química esté balanceada, es decir, que el número de átomos de cada elemento de las sustancias reaccionantes y de los productos de la reacción sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce es en las reacciones nucleares.
COMO ESCRIBIR UNA ECUACIÓN QUÍMICA:
- Los pasos seguidos para escribir una ecuación química son:
- Los reactivos y productos de la reacción son identificados y anotados.
- La fórmula o símbolos de los reactivos se escriben en el lado izquierdo con un signo ‘+’ entre ellos.
- La fórmula o símbolos de los productos se escriben en el lado derecho con un signo ‘+’ entre ellos.
- Los dos lados (reactivos y productos) se separan por una flecha (→) apuntando hacia los productos.
- Para una reacción reversible, una doble flecha (
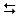 ) se utiliza en lugar de una flecha.
) se utiliza en lugar de una flecha. - El número de átomos de cada elemento se cuenta en ambos lados. Si son iguales, entonces se denomina una ecuación química balanceada. Si no son iguales, el equilibrio de la ecuación se realiza ajustando los coeficientes antes de los símbolos y la fórmula de los reactivos y productos según la ley de la conservación de la masa.
- En términos cualitativos, una ecuación química transmite los nombres de los diversos reactivos y los productos.
- En términos cuantitativos, representa el número relativo de átomos y moléculas que participan en la reacción, el número relativo de moles de los reactivos y productos, las masas relativas de los reactivos y productos y los volúmenes relativos de reactivos y productos gaseosos.
EJEMPLO:
- Comencemos simplemente escribiendo una ecuación química en términos de las fórmulas de las sustancias, recordando que tanto el hidrógeno elemental como el cloro son diatómicos:
H2 + Cl2 → HCl
- Hay dos átomos de hidrógeno y dos átomos de cloro en los reactivos y uno de cada átomo en el producto. Podemos fijar esto incluyendo el coeficiente 2 en el lado del producto:
H2 + Cl2 → 2HCl
- Ahora hay dos átomos de hidrógeno y dos átomos de cloro en ambos lados de la ecuación química, por lo que es equilibrado.
CONCLUSIONES:
- Una reacción química es un proceso el cual dos se transforman, cambiando su estructura molecular y así convirtiéndose en otras sustancias llamadas productos, cuando hacemos un balanceo se debe tener en cuenta con que tipo de reacción tratamos y así hacer un procedimiento correcto.
- Una ecuación química es una descripción simbólica de una reacción química que nos muestra como las sustancias que reaccionan así creando otras llamadas productos.
WEBGRAFIA:
- https://quimica.laguia2000.com/conceptos-basicos/tipos-de-reacciones-quimicas
- http://www.iered.org/archivos/Proyecto_coKREA/REAfinales2014/ReaccionesQuimicas_MagalyHenao/clases_de_reacciones_qumicas.html
- https://www.lifeder.com/partes-de-ecuacion-quimica/
- https://es.wikipedia.org/wiki/Ecuaci%C3%B3n_qu%C3%ADmica
AUTOR: DIANA KATHERYN ALFARO SANCHEZ



Le falto màs consulta con ejemplos 4.0
ResponderEliminar