Neutralizacion, Ph y Titulación
Neutralizacion:
INTRODUCCIÓN:
OBJETIVOS:
- Profundizar en los conceptos de la neutralizacion y aprender como se combinan los ácidos y las bases.
- Reconocer la aplicación de la neutralizacion según las formulas.
- Identificar la ecuación correcta al resolver un ejercicio dependiendo los datos dados.
MARCO TEÓRICO:
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua. La más común es la reacción de un ácido fuerte contra una base fuerte.
INTRODUCCIÓN:
En este blog se hablara sobre la neutralizacion, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de combinar los ácidos y las bases en una reacción .
OBJETIVOS:
- Profundizar en los conceptos de la neutralizacion y aprender como se combinan los ácidos y las bases.
- Reconocer la aplicación de la neutralizacion según las formulas.
- Identificar la ecuación correcta al resolver un ejercicio dependiendo los datos dados.
MARCO TEÓRICO:
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua. La más común es la reacción de un ácido fuerte contra una base fuerte.
En el momento de la neutralización se cumple que el número de equivalentes de ácido que han reaccionado es igual al número de equivalentes de la base.
Ejemplo:
La más común es la reacción de un ácido fuerte contra una base fuerte. Algunos ejemplos veremos a continuación para mostrar casos de neutralización.
HCl + NaOH —-> NaCl + H2O
En este caso vemos al ácido clorhídrico contra el hidróxido de sodio. Genera cloruro de sodio y agua. En este caso basta una molécula de ácido con una molécula de la base para generar la sal. Pero no siempre es asi.
Este principio se usa para averiguar la molaridad de un ácido o de una base gracias a un procedimiento llamado valoración ácido base o titulación ácido base.
EJERCICIO DE APLICACIÓN DE NEUTRALIZACION:

Se consumieron 60 ml de NaOH 0,4 M contra un volúmen de H2SO4 en el erlenmeyer de 100 ml.
Los moles agregados de NaOH son:
0,4 M x 0,060 litros: 0,024 moles
Según la reacción, la cantidad de moles de NaOH es el doble del H2SO4: Entonces de H2SO4 habrán 0,012 moles. La molaridad de H2SO4 será:
M = 0,012 moles / 0,1 litro (100 ml)
M = 0,12 M
PROCEDIMIENTO DE NEUTRALIZACION:
* Combinación los ácidos y las bases en una reacción de neutralización para producir una sal y agua.
Hidróxido de potasio + Ácido nítrico
* SE ELIGE UNA BASE DE LA BANDEJA SUPERIOR Y SE AGREGA AL VASO
Hidróxido de potasio + Ácido clorhídrico
*AHORA SE LE AGREGA UN ACIDO AL VASO DE PRECIPITADOS
Hidróxido de potasio + Ácido sulfúrico
* Hidróxido de sodio + Ácido nítrico
Para mas sustancias como ácidos y bases se puede probar mezclando diferentes tipos de ácidos con hidróxidos.
Ph e indicadores:
INTRODUCCIÓN:
OBJETIVOS:
- Profundizar en los conceptos del ph e indicadores y aprender como se combinan los sustancias.
- Reconocer la aplicación del ph e indicadores y porque cambian de color y las sustancias.
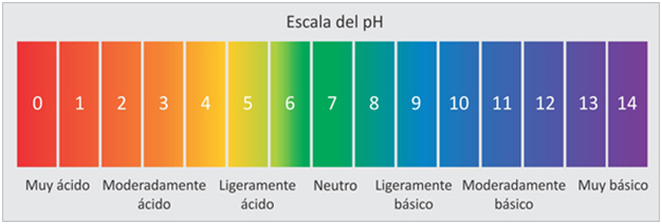
- Identificar la escala métrica para hallar el ph de cualquier medio.
MARCO TEÓRICO:
Los indicadores son colorantes orgánicos, que experimentan una variación de color que se puede observar en una escala numérica llamada escala pH. Según estén en presencia de una sustancia ácida o básica el color es de un tono determinado.
Este indicador está dividido en ácidos y bases y en la parte central donde se encuentran estas dos substancias, se encuentra otro tipo de carácter llamado neutro, en el que la substancia está equilibrada. Es decir, tiene tanto carácter básico como ácido
El medir el pH de los productos es un paso imprescindible de los procesos de fabricación, para determinar esta unidad se pueden utilizar indicadores de pH, que son sustancias que reaccionan en un medio al cambiar de color para indicar la acidez o alcalinidad del producto.
El cambio de color del indicador se debe a que al aumentar o disminuir la acidez o alcalinidad de la disolución, se genera un cambio químico estructural que hace que el numero de protones del elemento aumenten o disminuyan. Estos indicadores también suelen ser llamados indicadores ácido-base y tienen un viraje de una unidad arriba y otra abajo de pH. Los más conocidos son: el naranja de metilo, que vira en un intervalo de pH 3, 1-4, 4, de color rojo a naranja y la fenolftaleína, que vira desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados / violetas.
Los indicadores presentan un comportamiento muy sencillo. Estos elementos se constituyen de una forma ácida o una forma básica débil con una forma general. Al estar en las sustancias, si se ioniza por un aumento o disminución de los ácidos o las bases, se desencadenará una reacción creando una forma conjugada produciendo un nuevo elemento que tiñe las disoluciones.
PROCEDIMIENTO DE PH E INDICADORES:
* Fenolftaneina: Es un indicador de pH que en soluciones ácidas permanece incoloro, pero en presencia de bases se torna rosa o violeta. Es un sólido blanco, inodoro que se forma principalmente por reacción del fenol y ácido sulfúrico (H2SO4); sus cristales son incoloros.
*PH de una solución mediante de un indicador.
*Se estudia los tres indicadores:Tornasol, fenolftaleina y universal.
* Indicador del ph en la fenolftaleina.
* Universal: Un indicador universal es un indicador de pH hecho de una solución de varios compuestos que exhibe varios cambios de color suaves en un amplio rango de valores de pH para indicar la acidez o alcalinidad de las soluciones.
* Indicador del ph universal
* Tornasol: El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un índice de pH de 4,5 y oscurece solo ligeramente con los alcalinos, por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases.
* Indicador del ph de tornasol.
TITULACIÓN:

INTRODUCCIÓN:
En este blog se hablara sobre la neutralizacion, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de combinar los ácidos y las bases en una reacción .

INTRODUCCIÓN:
En este blog se hablara sobre la neutralizacion, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de combinar los ácidos y las bases en una reacción .
OBJETIVOS:
- Profundizar en los conceptos de la neutralizacion y aprender como se combinan los ácidos y las bases.
- Reconocer la aplicación de la neutralizacion según las formulas.
- Identificar la ecuación correcta al resolver un ejercicio dependiendo los datos dados.
MARCO TEÓRICO:
La Neutralización ácido base es un proceso mediante el cual un ácido reacciona con una base o hidróxido y da como resultado una sal y agua. La más común es la reacción de un ácido fuerte contra una base fuerte.
INTRODUCCIÓN:
En este blog se hablara sobre la neutralizacion, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de combinar los ácidos y las bases en una reacción .
En este blog se hablara sobre la neutralizacion, sus conceptos, aplicación y ejercicios con los cuales podemos realizar un proceso correcto a la hora de combinar los ácidos y las bases en una reacción .
OBJETIVOS:
- Profundizar en los conceptos de la neutralizacion y aprender como se combinan los ácidos y las bases.
- Reconocer la aplicación de la neutralizacion según las formulas.
- Identificar la ecuación correcta al resolver un ejercicio dependiendo los datos dados.
MARCO TEÓRICO:
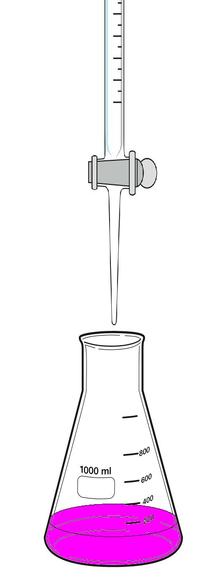
La titulación es un procedimiento relativamente sencillo que no requiere un despliegue de aparatos técnicos para determinar la concentración de sustancias conocidas disueltas. Los instrumentos esenciales para la titulación son una bureta y un vaso de precipitados. En el vaso de precipitados se encuentra la solución con la concentración desconocida y un indicador para la detección del parámetro. Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra.
Por ejemplo, existe la titulación ácido-base, la titulación redox o la titulación por precipitación. La titulación es aplicada en muchos ámbitos: En el análisis medioambiental, en el control de procesos, en el análisis farmacológico y forense, en el análisis de alimentos o también en la investigación.
Titulación ácido-base: El fundamento de la titulación ácido-base es la reacción de neutralización entre ácidos y base. Como solución volumétrica se selecciona un ácido o base como complemento a la solución de prueba. Mediante la titulación se consigue una neutralización entre iones H3O+- y OH-. Si se alcanza el valor pH 7 la solución es neutra; añadiendo más solución volumétrica la solución de prueba se volverá más ácido o básico.
Titulación redox: En la titulación redox se deja reaccionar la solución de prueba con una solución volumétrica oxidada o reducida. Se añade la solución volumétrica hasta que todas las sustancias que puedan reaccionar en la solución de prueba hayan sido oxidadas o reducidas.
Titulación por precipitación: La titulación por precipitación combina muy bien sustancias muy solubles con sustancias que no se diluyen tan bien. Se consigue obtener el resultado una vez que la reacción química se ha completado y sea claramente visible la caída de la sustancia que se diluye con dificultad.
La titulación es un procedimiento relativamente sencillo que no requiere un despliegue de aparatos técnicos para determinar la concentración de sustancias conocidas disueltas. Los instrumentos esenciales para la titulación son una bureta y un vaso de precipitados. En el vaso de precipitados se encuentra la solución con la concentración desconocida y un indicador para la detección del parámetro. Después de mezclar la solución volumétrica y la solución con la muestra en el vaso de precipitados es posible, en base al conocimiento del desarrollo químico de reacción y el consumo de la solución volumétrica, calcular la concentración de la solución con la muestra.
Por ejemplo, existe la titulación ácido-base, la titulación redox o la titulación por precipitación. La titulación es aplicada en muchos ámbitos: En el análisis medioambiental, en el control de procesos, en el análisis farmacológico y forense, en el análisis de alimentos o también en la investigación.
Titulación ácido-base: El fundamento de la titulación ácido-base es la reacción de neutralización entre ácidos y base. Como solución volumétrica se selecciona un ácido o base como complemento a la solución de prueba. Mediante la titulación se consigue una neutralización entre iones H3O+- y OH-. Si se alcanza el valor pH 7 la solución es neutra; añadiendo más solución volumétrica la solución de prueba se volverá más ácido o básico.
Titulación redox: En la titulación redox se deja reaccionar la solución de prueba con una solución volumétrica oxidada o reducida. Se añade la solución volumétrica hasta que todas las sustancias que puedan reaccionar en la solución de prueba hayan sido oxidadas o reducidas.
Titulación por precipitación: La titulación por precipitación combina muy bien sustancias muy solubles con sustancias que no se diluyen tan bien. Se consigue obtener el resultado una vez que la reacción química se ha completado y sea claramente visible la caída de la sustancia que se diluye con dificultad.
PROCEDIMIENTO DE TITULACIÓN:
*Una solución de concentración conocida, llamada solución valorada, se agrega con una bureta a la solución que se analiza.
* la adición se detiene cuando se ha agregado la cantidad de reactivo determinada en función de un cambio de coloración en el caso de utilizar un indicador interno, y especificada por la siguiente ecuación de la titulación.
*cantidades equivalentes de ácidos y bases se llama neutralización o reacción de neutralización, la característica de una reacción de neutralización es siempre la combinación de hidrogeniones que proceden del ácido, con hidroxiliones procedentes de la base
*se combina con una solución de concentración desconocida para determinar dicha concentración, la curva de titulación es la gráfica que indica como el pH de la solución cambia durante el transcurso de la misma
WEBGRAFIA:
http://ciencia-basica-experimental.net/titulacion.htm
https://es.wikipedia.org/wiki/Indicador_de_pH
http://www.ehu.eus/biomoleculas/ph/neutra.htm




FALTO UN POCO MAS DE MARCO TEORICO 4,3
ResponderEliminar